Átomo Cuántico
|
Actividad de Aprendizaje: |
Relata los principales
cambios que ha sufrido el Átomo, con el paso del tiempo y con el surgimiento
de nuevas teorías que intentan describir su estructura interna. |
La teoría del átomo, que como todos sabemos
significa indivisible, fue desarrollada por vez primera por el filósofo griego
Demócrito de Abdera, quien contraponiéndose a la
concepción de la materia de Aristóteles, propuso que la materia estaba
compuesta esencialmente por partículas indivisibles llamadas átomos.
Dalton en el siglo antepasado retomó la
teoría de Demócrito para explicar cómo se efectuaban las reacciones químicas.
Entre otras propuestas, dio características a los átomos.
A fines del siglo antepasado, J. J. Thomson
descubrió que del cátodo caliente de un tubo de rayos catódicos
se desprendían partículas que se aceleraban por medio de un potencial positivo
grande en el ánodo. A estas partículas les llamó electrones. El desprendimiento
de electrones un cátodo caliente, por
procedimientos físicos, mostró a Thomson
que de los átomos se podían obtener partículas menores, integrantes de los
mismos, por lo que los átomos dejaban de ser átomos.
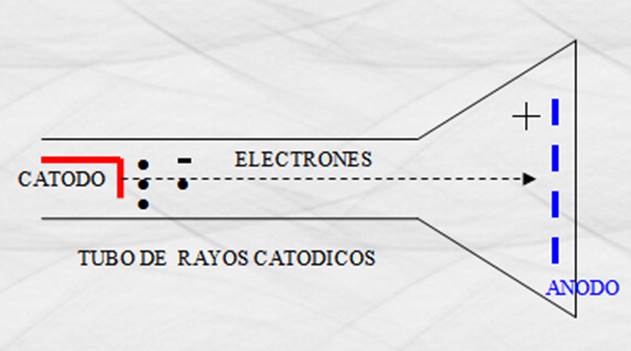
Figura 156. Tubo de rayos catódicos.
Basado en experimentos, en 1911, J. J.
Thomson propone un modelo de cómo están
constituidos los átomos; según él, un átomo es semejante a un budín con ciruelas; la masa del budín corresponde
con la mayor parte de la masa del átomo y tiene una carga positiva; y como la
materia es eléctricamente neutra, las ciruelas inmersas en el budín tienen una
carga negativa de magnitud total igual a la positiva de la mayor masa.
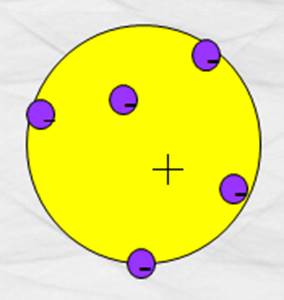
Figura 157. Modelo atómico de Thomson.
Ernest Rutherford, basado en el modelo del átomo
de Thomson, trató de probarlo bombardeando núcleos de una lámina de oro muy
delgada con partículas alfa (partícula alfa igual a el núcleo de un átomo de
helio, compuesta de una masa de dos protones más la de dos neutrones y una carga de dos protones) obtenidas por
radiación. Realizados los experimentos, Rutherford descubre que el modelo de Thomson no
concuerda con la realidad y propone un modelo nuevo que consiste en un núcleo
macizo con carga eléctrica positiva, donde se concentra la masa del átomo y girando
en órbitas circulares una nube de electrones negativos cuya carga total sumada es igual a la del
núcleo, de manera semejante a nuestro Sistema Solar.

Figura 158. Modelo atómico de Rutherford.
En base a los cálculos efectuados, propone
que las dimensiones del núcleo del átomo de hidrógeno son 10-14 m y
las del átomo, desde luego incluyendo al electrón, 10-10 m.
La suposición de electrones girando en
órbitas circulares indujo a considerar que el átomo era inestable, ya que los electrones
cuando se aceleran, debido a su fuerza centrípeta, para mantenerse en órbita
emiten ondas electromagnéticas; y al emitir energía electromagnética, los
electrones la restaban a la energía para mantenerse en órbita, reduciendo el
radio de ésta hasta caer en el núcleo, lo que no acontece.
Por otro lado, experimentalmente se
encontró que los electrones excitados con
cualquier otro tipo de energía, emiten energía electromagnética que
puede ser capturada en un espectrómetro. Cada tipo de átomo emite ondas
electromagnéticas en ciertas frecuencias solamente y no en todas como supuso
Rutherford.
Tomando en cuenta los sucesos descritos en
los párrafos anteriores, Niels Bohr, propuso un nuevo modelo para el átomo,
compuesto de un núcleo macizo eléctricamente positivo y electrones estables
girando en órbitas circulares. Estos electrones son capaces de emitir ondas
electromagnéticas solo si saltan de una órbita a otra de energía menor, mas si
se mantenían girando en su órbita no emitían onda alguna. Para que se cumpla
esto, los electrones deben tener una cantidad de movimiento angular o momento
angular igual a un número entero o múltiplo de h/2p,
cantidad de movimiento angular propia de las órbitas.

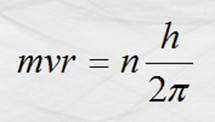 Primer
postulado.
Primer
postulado.
Donde h es la constante de Plank, tomada, desde luego de la teoría cuántica de la luz
propuesta por éste, que tiene un valor de 6.63 x 10-34 J s; se
denomina número cuántico principal y vale 1, 2, 3, …,
n.
Los electrones en estas órbitas giran sin
emisión de radiación.
Si los ganan energía saltan de una órbita
externa a una interna y la diferencia de energías es radiada en forma de ondas
electromagnéticas. Si un electrón pierde energía salta de una órbita interna a
una externa y la diferencia de energías es radiada en forma de radiación
electromagnética. La energía de las ondas emitidas se calcula con el modelo:
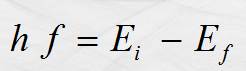 Segundo
postulado.
Segundo
postulado.
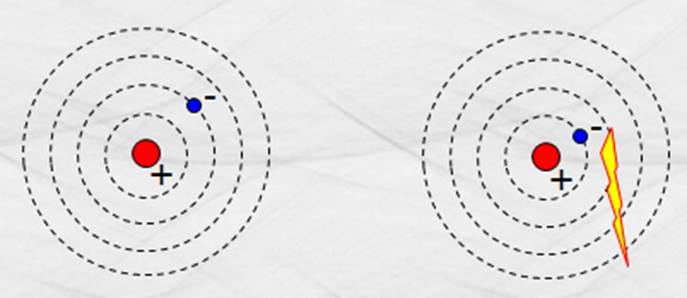
Figura 159. Modelo atómico de Bohr.
La energía electromagnética emitida por el
hidrógeno al ser calentado y capturado en el espectrómetro ya había sido estudiada
por el científico Johann Jakob Balmer, quien encontró
una relación matemática sencilla para predecir las longitudes de onda
características de algunas de las líneas en el espectro del hidrógeno; su
fórmula es :
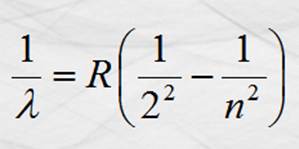
En la que l es la longitud de onda de las ondas
electromagnéticas emitidas por el electrón cuando salta de un nivel a otro. R
es la constante de Rydberg, R = 1.097 x 107
m-1 y n es el nivel de energía contado desde n =3.
Este modelo obtenido de hechos
experimentales, concuerda con el modelo de emisión de ondas electromagnéticas
propuesto por Bohr cuando un electrón salta de una órbita a otra. Esto en
cierta forma prueba que
Carga del Electrón
Los rayos catódicos son un conjunto de
electrones provenientes del cátodo de un tubo de vacío, fueron asociados con
los electrones por J.J. Thomson en base
a pruebas efectuadas a partículas cargadas en movimiento; descubiertas estas
partículas, Thomson midió la relación de la carga a la masa de los electrones e
indujo a Robert Millikan para llevar a cabo un
experimento que lleva su nombre a fin de conocer la carga del electrón. Millikan encontró, en su experimento de la gota de aceite
que todas las partículas cargadas tenían una carga múltiplo de 1.6 x10-
Como la materia es eléctricamente neutra,
se supuso que la carga del núcleo tenía la misma carga en magnitud.